Congonhas é um dos dez municípios, em todo Brasil, selecionados para receber consultoria técnica especializada da Anvisa (Agência Nacional de Vigilância Sanitária) para a revisão do Código Sanitário Municipal. A Vigilância Sanitária (Visa) congonhense foi selecionada em um processo seletivo que avaliou vários requisitos, entre eles a qualidade técnica da equipe de trabalho e a estruturação do setor. O processo de revisão da lei sanitária da cidade, que já estava em andamento, contou pontos para que a cidade fosse escolhida.
Ao longo de todo o ano, a Anvisa está prestando consultoria especializada, por meio de encontros virtuais e presenciais, para orientar e contribuir para a revisão dos Códigos de cidades em todo o país com base nas diretrizes previstas no documento técnico: “Manual para elaboração do Código Sanitário para o Sistema Nacional de Vigilância Sanitária (SNVS).
A coordenadora da Vigilância Sanitária de Congonhas, Renata Adriane, explica que ter a consultoria da Anvisa representa um ganho muito importante para a criação do novo Código Sanitário e para a melhoria da qualidade do trabalho do setor na cidade.
“Com a consultoria, teremos um código bem atualizado, condizente com as demandas da população e em concordância – inclusive – com a nova lei de liberdade econômica, com foco na gestão da qualidade do serviço prestado ao cidadão e no gerenciamento dos riscos das atividades”, comentou Renata.
BENEFÍCIOS DA CONSULTORIA PARA A VISA DE CONGONHAS
• Qualificação e capacitação dos profissionais da Vigilância Sanitária;
• Gestão da Qualidade e Gerenciamento de Riscos;
• Delimitação de todos os serviços prestados pelo setor;
• Controle social – prazos pré-determinados por diretrizes federais/estaduais para respostas aos requerentes de alvarás e demais documentos;
• Participação de vários setores nas ações da Visa para garantir a saúde integral da população;
• Revisão e atualização dos critérios municipais para regular o processo administrativo sanitário de acordo com as especificidades locais.
Em julho, representantes da Vigilância Sanitária participarão de um encontro presencial com a Anvisa que vai acontecer em Contagem. A expectativa da coordenação do setor é que até o final do ano, um dos encontros seja realizado em Congonhas.
Por Reinaldo Silva
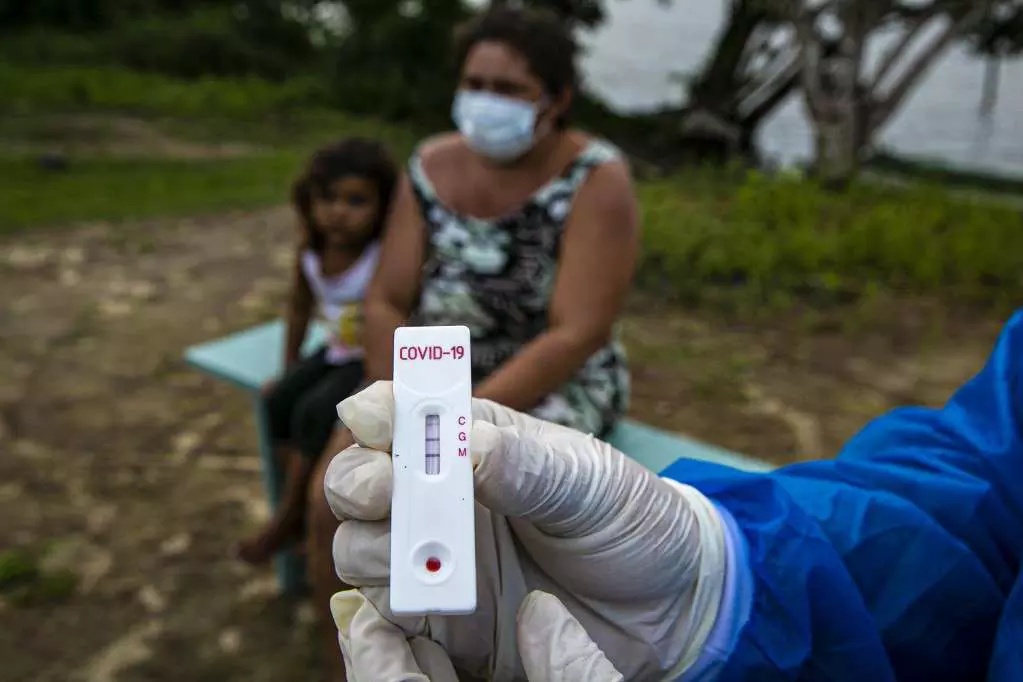
Anvisa libera venda de autotestes de Covid-19 em farmácias
Mesmo com a decisão, exames não estarão disponíveis nas prateleiras imediatamente, pois fabricantes precisam iniciar processo de registro dos produtos
A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu liberar a venda de autotestes de Covid-19 no país. A decisão teve unanimidade entre os quatro diretores da autoridade sanitária, em reunião realizada nesta sexta-feira (28).
A comercialização dos exames tem como objetivo ampliar os métodos de testagem, estimular o isolamento precoce e permitir a identificação do fim do período de transmissão da doença (com o resultado negativo após o isolamento), em meio à explosão de casos com a circulação da variante ômicron.
A política pública proposta pelo Ministério da Saúde não prevê a distribuição de autotestes pelo Sistema Único de Saúde (SUS). A venda será exclusiva em farmácias físicas ou virtuais e o exame será feito de forma 100% doméstica, com coleta nasal ou de saliva e resultado em torno de 10 a 20 minutos.
Caso o resultado seja positivo, a pessoa deverá se isolar imediatamente. Além disso, deverá procurar uma unidade de atendimento de saúde ou um teleatendimento para que um profissional da saúde realize a confirmação do diagnóstico e faça a notificação às autoridades sanitárias.
A avaliação por um profissional será necessária porque o autoteste funcionará como uma “triagem” e não será considerado como comprovante para viagens ou para licença médica laboral, por exemplo, porque a classificação da doença no laudo só pode ser assinada por um médico.
As orientações são para pacientes com sintomas leves de Covid-19. Em caso de quadros graves da doença, o Ministério da Saúde informou que a busca por atendimento médico deverá ser realizada imediatamente. A pasta também recomendou que os fabricantes disponibilizem um sistema de registro de resultados pela internet. O canal, no entanto, não é obrigatório.
Mesmo com a decisão pela aprovação, os autotestes não estarão disponíveis para compra imediata nas farmácias. Isso porque as marcas que fabricam os produtos ainda terão que pedir o registro, o que acontece também na Anvisa, com base na decisão desta sexta. Depois da liberação, as fabricantes poderão comercializar os exames.
A autoridade sanitária informou que irá intensificar o monitoramento por autotestes irregulares no mercado. Segundo a Anvisa, na próxima semana será iniciada uma ferramenta de varredura para identificar a venda de produtos sem registro.
Apesar de ter poder de voto, o presidente da Anvisa, Antonio Barra Torres, não participou da votação nesta sexta. Segundo a assessoria de imprensa, a ausência foi por motivo pessoal relacionado à saúde na família. A relatora foi a diretora Cristiane Rose Jourdan Gomes, que afirmou a “necessidade latente” de maior testagem no país.
Na avaliação dela, a liberação dos autotestes funciona como uma “excelente estratégia de triagem e controle da pandemia, principalmente porque neste momento o contágio é grande e muitas pessoas não conseguem ter acesso aos testes pelo SUS ou pelos laboratórios da rede privada”. Votaram também os diretores Meiruze Sousa Freitas, Alex Machado Campos e Rômison Rodrigues Mota.
Durante o voto, Rômison destacou a necessidade de acompanhamento dos preços dos produtos. Ele pontuou que houve aumento nos preços praticados ao redor do mundo por conta da alta demanda, mas defendeu que, no Brasil, os autotestes sejam comercializados a um valor inferior aos de uso profissional, já que dispensam a realização em laboratórios e farmácias e a execução por profissionais de saúde.
O diretor acrescentou que a Anvisa não tem poder de estabelecer preços máximos de dispositivos médicos, mas considerou “fundamental que os órgãos de proteção e defesa do consumidor continuem ações para coibir práticas de mercado que podem ser consideradas abusivas, uma vez que, a depender dos preços praticados, tais produtos não serão acessíveis a parcela considerável da população”.
A liberação da venda de autotestes estava na mesa dos diretores da Anvisa desde 14 de janeiro. Cinco dias depois, a autoridade sanitária decidiu adiar a decisão pela falta de uma política pública consistente para garantir a efetividade dos exames. Na noite de terça-feira (25), o Ministério da Saúde complementou as informações do processo.
FONTE O TEMPO
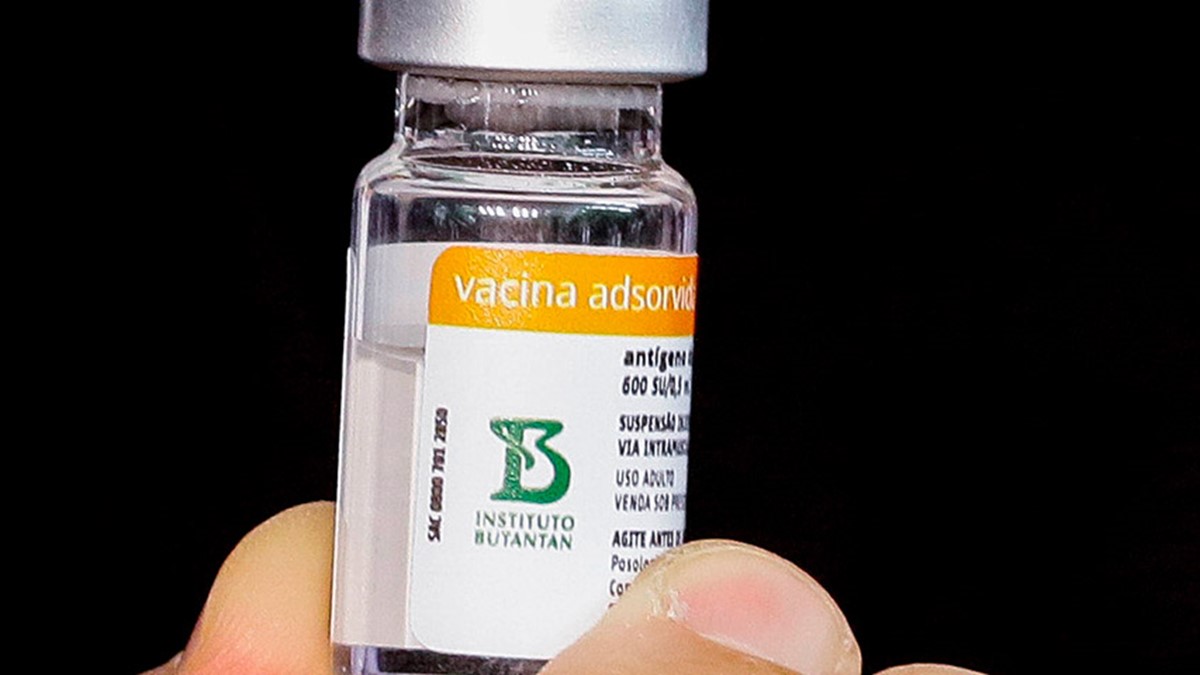
Anvisa veta uso emergencial da CoronaVac em crianças e adolescentes
Diretores da entidade entenderam que o Instituto Butantan deve elaborar mais estudos sobre eficácia e segurança do imunizante para uso pediátrico
A Agência Nacional de Vigilância Sanitária (Anvisa) vetou, nesta quarta-feira (18/8), o uso emergencial da CoronaVac em crianças e adolescentes. A votação ainda acontece, mas como cinco diretores opinam e quatro deles já foram contrários ao uso pediátrico do imunizante, não há mais chances de reversão do resultado.
Os diretores entenderam que o Instituto Butantan deve elaborar mais estudos sobre eficácia e segurança do imunizante no público pediátrico. A ideia era vacinar pessoas entre 3 e 17 anos. O pedido pode ser refeito por parte do Butantan
A apresentação foi iniciada pelo gerente de medicamentos e produtos biológicos da Anvisa, Gustavo Mendes. Ele destacou que os dados apresentados são insuficientes para analisar a segurança da CoronaVac em crianças e adolescentes.
“Os dados apresentados até o momento são insuficientes para estabelecer o perfil de segurança na população pediátrica, e também não permitem o conhecimento sobre a proteção e duração conferida pela vacina nessa população”, afirmou o gerente.
A votação dos diretores foi iniciada pela relatora, Meiruze Souza Freitas. Ela citou a incerteza de duração da proteção da CoronaVac para uso pediátrico e destacou que os estudos da fase 3 por parte do Instituto Butantan não estão completos. Além disso, Meiruze afirmou que a eficácia e imunogenicidade do imunizante é desconhecida em crianças com comorbidades. Por isso, votou contra o uso pediátrico do imunizante.
“É necessário gerar mais estudos e mais dados para verificar a eficácia e imunogenicidade da vacina na população pediátrica”, frisou a relatora.
Os diretores Romilson Rodrigues Mota, Alex Machado e Cristiane Rose Jourdan acompanharam, na íntegra, o voto da relatora Meiruze. Até a última atualização da matéria, o diretor-presidente da Anvisa, Antonio Barra Torres, ainda apresentava seu voto.
Na China, crianças de 3 a 17 anos já estão sendo vacinadas com CoronaVac. No Brasil, no entanto, o público de menor idade que está sendo imunizado é de 12 a 17 anos, com o imunizante fabricado pela Pfizer.
Uso emergencial prorrogado
Apesar de o uso da CoronaVac ter sido vetado neste primeiro momento em crianças e adolescentes, os diretores aprovaram a prorrogação do uso emergencial do imunizante em adultos, como vem sendo feito desde o início da vacinação.
A CoronaVac foi aprovada para ser utilizada emergencialmente no Brasil em adultos no dia 17 de janeiro. Além dela, o imunizante produzido pela Universidade de Oxford/AstraZeneca também teve o aval da Anvisa para ser usada.
FONTE ESTADO DE MINAS